Paludisme pendant la grossesse
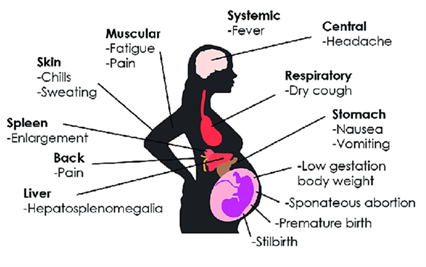
Les femmes enceintes et les enfants de moins de 5 ans constituent les catégories les plus exposées au risque d’infection et de complications liées au paludisme.
En 2015, on estime que 438 000 décès dus au paludisme ont été signalés dans le monde, dont environ 69 % concernaient des enfants de moins de 5 ans. Parmi tous les décès dus au paludisme, 90 % ont été signalés dans des régions africaines, le reste provenant de la région de l’Asie du Sud-Est et de la région de la Méditerranée orientale. Dans les zones d'endémie palustre, on estime qu'au moins 25 % des femmes enceintes sont infectées par le paludisme, qui provoque 10 000 décès maternels et 200 000 décès néonatals par an dans le monde (Schantz-Dunn et Nour, 2009).
En ce qui concerne la grossesse, le paludisme est dangereux à la fois pour la mère enceinte et pour le fœtus en développement (Saito et al., 2020) .
Le paludisme a tendance à être plus grave chez les femmes enceintes que chez les non-enceintes. Cela semble être dû aux changements hormonaux, immunologiques et hématologiques de la grossesse et à la présence du placenta. Pendant la grossesse, la réponse immunitaire à médiation cellulaire est interrompue, ce qui est nécessaire au développement du placenta et du fœtus. La suppression immunitaire générale pendant la grossesse rend les femmes plus sensibles à de nombreuses infections (y compris le paludisme), en particulier au cours du premier trimestre, et la faible réponse immunitaire à médiation cellulaire du placenta en fait le site privilégié où le parasite du paludisme se cache des réponses immunitaires de l'hôte (Sharma et Shukla, 2017).
En fait, Plasmodium falciparum est capable de s'accumuler dans le placenta de manière très spécifique (P. vivax ne séquestre pas dans le placenta)(McGready et al., 2004). Des études scientifiques ont montré que, in vitro, les érythrocytes infectés par les parasites du paludisme peuvent adhérer au sulfate de chondroïtine A et à l'acide hyaluronique, deux récepteurs exprimés sur les cellules endothéliales vasculaires du système placentaire, et les séquestrer dans le placenta (Rogerson et al., 2007).
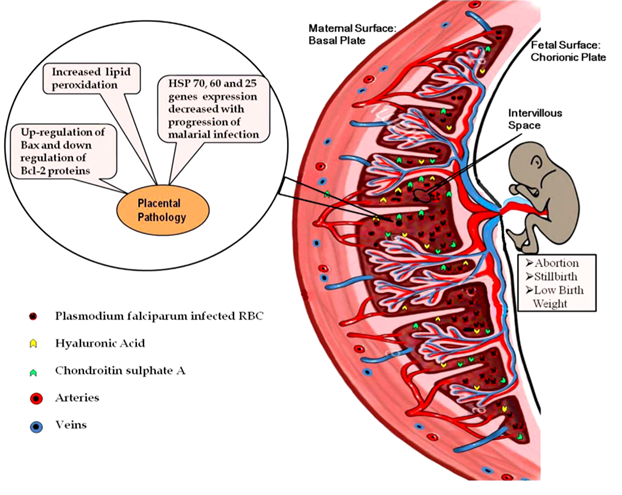
Le principal ligand du parasite, médiateur de l'adhésion du sulfate de chondroïtine A et de la séquestration placentaire, est un antigène de surface spécifique connu sous le nom de protéine VAR2CSA (Salanti et al., 2003; Duffy et al., 2005).
Cependant, à mesure que l'infection paludéenne progresse, on observe une augmentation de la réponse immunitaire à médiation cellulaire et une synthèse accrue de cytokines pro-inflammatoires, telles que le TNF, l'interleukine 2 et l'interféron γ, pour contrecarrer le parasite dans l'environnement placentaire local. Cela se traduit par un recrutement massif de macrophages et de lymphocytes T dans les espaces intervilleux du placenta. L'augmentation de la réponse immunitaire est délétère car elle provoque un stress oxydatif et la mort des cellules apoptotiques du placenta (Clark et al., 1986; Ockenhouse and Shear, 1984; Wozencraft et al., 1984; Sharma et al., 2012).
L'insuffisance placentaire à fournir des nutriments au fœtus a pour conséquences un retard de croissance intra-utérin, un faible poids à la naissance, des accouchements prématurés et des avortements.
L'infection paludéenne chez les femmes enceintes entraîne plutôt des complications cliniques, telles que l'anémie, l'œdème pulmonaire, l'hypoglycémie, le paludisme cérébral, la septicémie puerpérale et parfois la mort (Ménendez et al., 2000; Watkinson and Rushton, 1983).
La prévention
Dans les zones à faible transmission, la lutte contre le paludisme à P. falciparum pendant la grossesse dépend principalement de la détection précoce par le dépistage du paludisme chez les femmes asymptomatiques lors de la première visite prénatale, de la détection passive des cas symptomatiques et de l'administration de moustiquaires imprégnées d'insecticide dans le cadre des soins prénatals (Desai et al., 2018).
Dans les zones de transmission modérée à élevée de P. falciparum , la prévention du paludisme pendant la grossesse repose sur deux approches combinées. Le premier est représenté par les moustiquaires imprégnées d'insecticide et le second est le traitement préventif intermittent pendant la grossesse (TPIg) utilisant l'antipaludique sulfadoxine-pyriméthamine (SP) à intervalles prédéterminés.
Les directives antipaludiques les plus récentes de l'OMS (mars 2023) prévoient l'utilisation d'au moins trois doses de TPIp-SP pendant la grossesse. L'association médicamenteuse est administrée sous forme de trois comprimés (chaque comprimé contenant 500 mg/25 mg SP), pour la dose totale requise de 1 500 mg/75 mg SP. Le TPIg-SP doit débuter au cours du deuxième trimestre (pas avant la 13e semaine de grossesse) et les doses doivent être administrées à chaque contact de soins prénatals programmé (CPN) jusqu'au moment de l'accouchement, à condition que les doses soient espacées d'au moins un mois.
Malheureusement, un grand nombre de femmes ont développé une résistance à la SP (en particulier en Afrique orientale et australe) et son efficacité a donc diminué. La résistance à la SP résulte de différents polymorphismes mononucléotidiques dans les gènes codant pour la dihydrofolate réductase (DHFR) et la dihydroptéroate synthase (DHPS), cibles respectivement de la pyriméthamine et de la sulfadoxine (Rogerson et al., 2007 ; Van Eijk, 2019). Ceux-ci diminuent la sensibilité des parasites aux médicaments dans une mesure qui dépend du nombre et du type de mutations (White, 2005).
Outre le problème de la résistance aux associations de médicaments, il existe également d’autres types de problèmes (socioculturels, individuels, environnementaux, sanitaires) qui découragent leur prise.
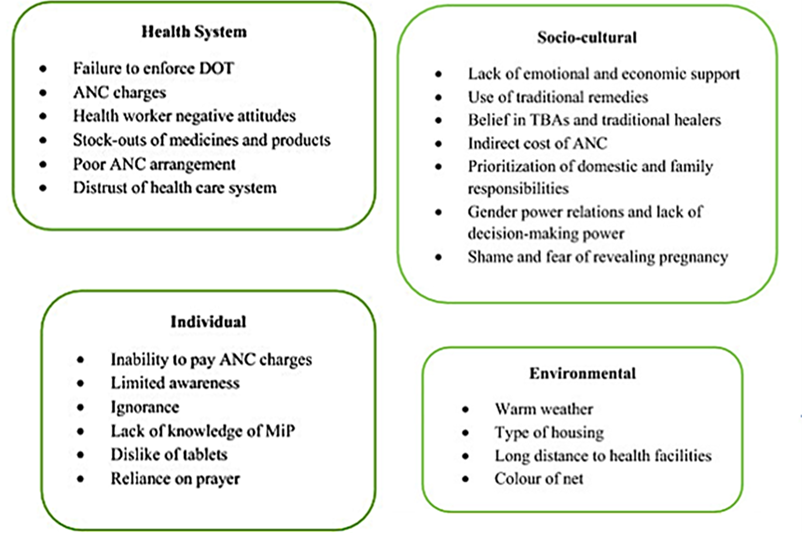
Facteurs du système de santé telles que l'incapacité à appliquer les thérapies directement observées, les frais pour les services de CPN et de TPIp-SP, les attitudes négatives des prestataires de santé maternelle, les ruptures de stock et les mauvaises dispositions en matière de CPN, l'incapacité à éduquer les femmes sur les avantages de la SP et le manque de personnel de santé, a démotivé les femmes enceintes d’accéder aux soins prénatals et de terminer le traitement TPIg-SP (Anders et al., 2008; Hill et al., 2013; Thiam et al., 2013; Pell et al., 2011; Olaleye and Walker, 2020).
Des facteurs individuels tels que la difficulté à avaler les comprimés, les effets secondaires potentiels des médicaments, la difficulté à payer les frais de CPN et l'ignorance découragent la prise du TPIg-SP (Nyaaba et al., 2021; Aberese-Ako et al., 2020; Aberese-Ako et al., 2021).
Des facteurs socioculturels tels que la honte d'être enceinte hors mariage ou d'être enceinte en même temps que leur mère, la pauvreté, l'absence de permission de leurs maris et des hommes chefs de famille pour assister aux soins prénatals, l'utilisation de remèdes traditionnels et anciens, entraîner une non-participation ou une participation irrégulière à l’ANC (Klein et al., 2016; Hill et al., 2015).
Facteurs environnementaux comme le climat chaud et la longue distance à parcourir pour se rendre aux établissements de santé, en particulier pour les femmes qui vivent dans les zones rurales, les ont démotivées à accéder au TPIg-SP (Azizi et al., 2018; Bhutta et al., 2009).
Source:
1. Aberese-Ako M., et al. (2022) Motivators and demotivators to accessing malaria in pregnancy interventions in sub-Saharan Africa: a meta-ethnographic review. Malar J. 21, 170
2. Aberese-Ako, M., et al. (2021) An ethnographic study of how health system, socio-cultural and individual factors influence uptake of intermittent preventive treatment of malaria in pregnancy with sulfadoxine-pyrimethamine in a Ghanaian context. PLoS ONE. 16
3. Aberese-Ako, M., et al. (2020) Managing intermittent preventive treatment of malaria in pregnancy challenges: an ethnographic study of two Ghanaian administrative regions. Malar J. 19, 347
4. Anders, K., et al. (2008) Timing of intermittent preventive treatment for malaria during pregnancy and the implications of current policy on early uptake in north-east Tanzania. Malar J. 7, 79
5. Azizi, S.C., et al. (2018) Uptake of intermittent preventive treatment for malaria during pregnancy with sulphadoxine-pyrimethamine (IPTp-SP) among postpartum women in Zomba District, Malawi: a cross-sectional study. BMC Pregnancy Childbirth. 18, 108
6. Bhutta, Z.A., et al. (2009) Delivering interventions to reduce the global burden of stillbirths: improving service supply and community demand. BMC Pregnancy Childbirth. 9
7. Clark, I.A., et al. (1986) Oxygen-derived free radicals in the pathogenesis of parasitic disease. Adv Parasitol. 25, 1-45
8. Desai, M., et al. (2018) Prevention of malaria in pregnancy. Lancet Infect Dis. 18
9. Hill, J., et al. (2013) Factors affecting the delivery, access, and use of interventions to prevent malaria in pregnancy in sub-Saharan Africa: a systematic review and meta-analysis. PLoS Med. 10
10. Hill, J., et al. (2015) Access and use of interventions to prevent and treat malaria among pregnant women in Kenya and Mali: a qualitative study. PLoS ONE. 10
11. Klein, M.C., et al. (2016) “There is no free here, you have to pay”: actual and perceived costs as barriers to intermittent preventive treatment of malaria in pregnancy in Mali. Malar J. 15, 158
12. McGready, R., et al. (2004) The effects of Plasmodium falciparum and P. vivax infections on placental histopathology in an area of low malaria transmission. Am J Trop Med Hyg. 70, 398-407
13. Menendez, C., et al. (2000) The impact of placental malaria on gestational age and birth weight. J Infect Dis. 181,1740-5.
14. Nyaaba, G.N., et al. (2021) A socio-ecological approach to understanding the factors influencing the uptake of intermittent preventive treatment of malaria in pregnancy (IPTp) in South-Western Nigeria. PLoS ONE. 16
15. Ockenhouse, C.F., Shear, H.L. (1984) Oxidative killing of the intra erythrocytic malaria parasite P. yoelii by activated macrophages. J Immunol. 132, 424-31
16. Olaleye, A.O., Walker, O. (2020) Impact of health systems on the implementation of intermittent preventive treatment for malaria in pregnancy in sub-Saharan Africa: a narrative synthesis. Trop Med Infect Dis. 5, 134
17. Pell, C., et al. (2011) Social and cultural factors affecting uptake of interventions for malaria in pregnancy in Africa: a systematic review of the qualitative research. PLoS ONE. 6
18. Rogerson, S.J., et al. (2007) Malaria in Pregnancy: Linking Immunity and Pathogenesis to Prevention. Am J Trop Med Hyg. 77, 14-22
19. Schantz-Dunn, J., Nour, N.M. (2009) Malaria and pregnancy: a global health perspective. Rev Obstet Gynecol. 2, 186-92
20. Sharma, L., et al. (2012) Role of oxidative stress and apoptosis in the placental pathology of Plasmodium berghei infected mice. PLoS One. 7
21. Sharma, L., Shukla, G. (2017) Placental Malaria: A new insight into the Pathophysiology. Front Med (Lausanne). 4, 117
22. Thiam, S., et al. (2013) Why are IPTp coverage targets so elusive in sub-Saharan Africa? A systematic review of health system barriers. Malar J. 12, 353
23. Van Eijk, A. M., et al. (2019) Effect of Plasmodium falciparum sulfadoxine-pyrimethamine resistance on the effectiveness of intermittent preventive therapy for malaria in pregnancy in Africa: a systematic review and meta-analysis. Lancet Infectious Diseases. 19, 546-56
24. Watkinson, M., Rushton, D.I. (1983) Plasmodial pigmentation of placenta and outcome of pregnancy in West African mothers. Br Med J.287, 251-4
25. White, N.J. (2005) Intermittent presumptive treatment for malaria. PLoS Med. 2.
26. Wozencraft, A.O., et al. (1984) Killing of human malaria parasite by macrophage secretory products. Infect Immun. 43, 664-9
· www.who.int